Risikorechner
Lorem ipsum dolor sit amet consectetur. Sit vehicula velit donec sit suspendisse donec. Malesuada massa rhoncus quam ullamcorper.
Zusatzinformationen
Ulkus
Personen mit Ulzera in der Vorgeschichte haben ein bis 36-fach erhöhtes Risiko, im Verlaufe der Zeit ein erneutes Ulkus zu erleiden. Verschiedene Studien zeigten nach Abheilung einer ersten Läsion eine Rezidivrate von bis 40% in den nachfolgenden 1-2 Jahren. Massgeblich für die Wahrscheinlichkeit eines Rezidivs ist nebst einer PAVK sowie meist kleinen Traumata auch die Stelle, an der das Ulkus auftritt. Eine sehr hohe Rezidivrate wird v.a. bei plantaren Ulzera am Grosszehengrundgelenk beobachtet.
Pound N, Chipchase S, Treece K et al. Ulcer-free survival following management of foot ulcers in diabetes. Diabet Med 2005; 22:1306-1309 ; Peters EJ, Armstrong DG, Lavery LA. Risk factors for recurrent diabetic foot ulcers: site matters. Diabetes Care 2007; 30:2077-2079; Waaijman R. et al.: Risk factors for plantar foot ulver recurrence in neuropathic diabetic patients, Diabetes Care 2014; 37(6): 1697-1705.
Zusatzinformationen
Amputation
Das Risiko für Reamputationen bei Personen mit Diabetes ist sehr hoch. In einer Studie betrug das kumulative Risiko reamputiert zu werden nach 1 Jahr 27%, nach 3 Jahren 48% und nach 5 Jahren gar 61%. Dabei war nicht nur die ipsilaterale sondern auch die kontralaterale Extremität betroffen. Das höchste Risiko für eine erneute Amputation am bereits operierten Bein war in den ersten 6 Monaten zu beobachten. Wichtig anzumerken ist, dass Amputationen abhängig vom Amputationslevel und von weiteren Co-Morbiditäten mit einer deutlich erhöhten peri- und postoperativen Mortalität assoziiert sind. Die kumulative 5-Jahres-Mortalitätsrate liegt gemäss einer neueren Studie bei 46%.
Izumi Y, Satterfield K, Lee S, Harkless LB: Risk of reamputation in diabetic patients stratified by limb and level of amputation: A 10-year observation. Diabetes Care 2006, 29:566-570; Morbach S. et al. Long term prognosis of diabetic foot patients and their limbs, Diabetes Care 2012
Zusatzinformationen
Fusspulse
Obwohl abhängig von Umgebungstemperatur und Können des Untersuchers ist die Palpation der Fusspulse ein zentraler Bestandteil der klinischen Untersuchung von Patienten mit Diabetes, sowohl im Kontext der jährlichen Vorsorgeuntersuchung als auch im Fall eines akuten Problems. Eine klinisch relevante periphere arterielle Verschlusskrankheit (pAVK) kann in den meisten Fällen ausgeschlossen werden, wenn sowohl dorsalis pedis als auch tibialis posterior Puls beidseitig palpabel sind. Bedacht werden muss jedoch, dass insbesondere bei Patienten mit Diabetes mellitus und tastbaren Fusspulsen signifikante Gefässstenosen gelegentlich auch einmal weiter distal vorhanden sein können. Umgekehrt fehlen bei bis zu 8% gesunder Personen der dorsalis pedis Puls und bei bis zu 3% der tibialis posterior Puls. Bei nicht tastbaren Pulsen ist eine angiologische Abklärung zu erwägen.
Bakker K, Apelqvist J, Schaper NC; International Working Group on Diabetic Foot Editorial Board: Practical guidelines on the management and prevention of the diabetic foot 2011. Diabetes Metab Res Rev 2012 ; 28(Suppl 1):218ff; Lepäntalo M et al. Chapter V - The Diabetic Foot. Eur J Vasc Endovasc Surg. 2011, 42(Suppl 2):S60-74.
Zusatzinformationen
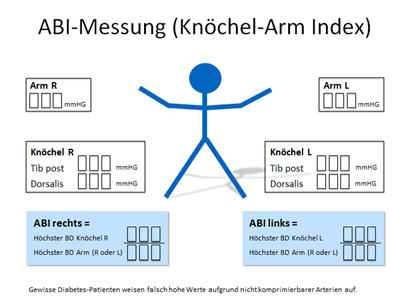
ABI-Messung
Das relative Risiko für eine peripher arterielle Verschlusskrankheit steigt pro Anstieg des HbA1c um 1% um 25-30%. Die Ermittlung des Knöchel-Arm Index (ABI), welche die Bildung des Quotienten aus der Messung des jeweils höheren systolischen Blutdrucks der A. dorsalis pedis und A. tibialis posterior am Fuss sowie beider Arme nach 10 Minuten Ruhe am liegenden Patienten umfasst, ist eine validierte, gut reproduzierbare und nicht invasive Methode zur Abschätzung der arteriellen Durchblutung der unteren Extremitäten. Sensitivität und Spezifität im Vergleich zu einer angiographisch gesicherter pAVK betragen 95–100%. Bei der Interpretation müssen jedoch gewisse Limitationen beachtet werden. Unter anderem können kalzifizierte, schlecht kompressible Gefäße bei Patienten mit Diabetes (Mediasklerose) zu falsch hohen Werten führen. Inkompressible Arterien (ABI >1,3) finden sich bei 30% der Patienten mit diabetischem Fussulkus. Ein ABI < 0,9 ist hochsuspekt bzgl. des Vorhandenseins einer pAVK. Wenn eine Wunde innert nützlicher Frist (6 Wochen) keine Heilungstendenz zeigt, empfiehlt sich unabhängig vom Ergebnis der ABI-Messung die grosszügige Indikationsstellung zur weiterführenden angiologischen Beurteilung (Zehenverschlussdruckmessung.
American Diabetes Association: Peripheral arterial disease in people with diabetes. Diabetes Care 2003; 26(12):3333ff; Bakker K, Apelqvist J, Schaper NC; International Working Group on Diabetic Foot Editorial Board: Practical guidelines on the management and prevention of the diabetic foot 2011. Diabetes Metab Res Rev 2012; 28(Suppl 1):218ff; Lepäntalo M et al. Chapter V: The Diabetic Foot. Eur J Vasc Endovasc Surg. 2011; 42(Suppl 2):S60-74. N. C. et al. Diagnosis and treatment of peripheral arterial disease in diabetic patients with a foot ulcer. A progress report of the International Working Group on the Diabetic Foot. Diabetes Metab Res Rev 2012; 28(Suppl 1): 218–224.
Zusatzinformationen
Monofilament
Das Semmes-Weinstein Monofilament ist das am häufigsten eingesetzte Instrument zur Früherkennung einer sensorischen Neuropathie. Das Unvermögen, den Druck des 10g Nylonfilaments an ≥ 1 Stelle zu spüren, ist mit dem Vorhandensein einer klinisch signifikanten ‚large-fiber’- Neuropathie assoziiert. Sensitivität und Spezifität des Tests zur Identifizierung von Patienten mit erhöhtem Risiko für Fussulzera lagen in prospektiven Studien bei 65-90% resp. 35-85%. Die Monofilament-Untersuchung sollte in ruhiger, entspannter Atmosphäre erfolgen, so dass sich der Patient konzentrieren kann. Zunächst wird dem Patienten am Unterarm demonstriert, was er spüren sollte. Danach werden beide Füsse untersucht. Der Patient soll aufgefordert werden, seine Augen zu schliessen, damit er nicht sieht, wann und wo das Monofilament appliziert wird. Die vier im Minimum an der Fusssohle zu testenden Stellen (pro Fuss) sind in der Abbildung blau markiert. Setzen Sie das Monofilament gegebenenfalls am Rande beschwielter oder stark verhornter Stellen ein. Üben Sie so viel Druck aus, dass sich das Monofilament biegt und halten Sie es für ca. 1 Sekunde an Ort und Stelle. Bitten Sie den Patienten „ja“ zu sagen, wenn er glaubt das Monofilament sei appliziert. Fragen Sie ihn gegebenenfalls wo er den Druck verspürt. Ein Patient mit ausreichend protektiver Sensibilität muss im Minimum alle 4 zu untersuchenden Stellen korrekt identifizieren.
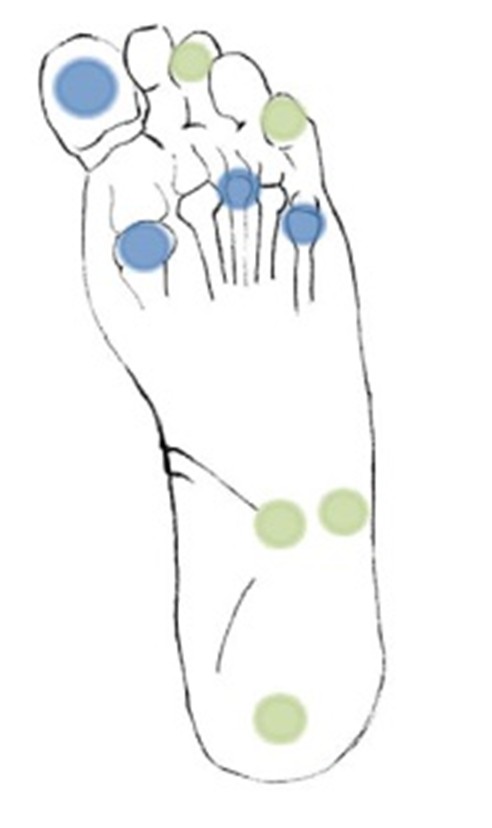
BILDLEGENDE Blau: Stellen, die 90% der Patienten mit einem pathologischem Monofilamenttest identifizieren; weisshellgrün: andere empfohlene Stellen.
Singh et al. Preventing Foot Ulcers in Patients with Diabetes. JAMA, 2005; 293(2):217-228; Boulton AJM et al. Comprehensive Foot Examination and Risk Assessment. Diabetes Car 2008; 31(8):1679-1685.
Zusatzinformationen
Vibrationssinn
Die Prüfung des Vibrationsempfindens (Pallästhesie) am medialen Grosszehengrundgelenk mit der 128Hz Stimmgabel ist ein weiterer einfacher Test bezüglich Vorliegen einer sensorischen Neuropathie. Die skalierte (0-8/8) Stimmgabel korreliert sehr gut mit den Ergebnissen eines Biothesiometers (r, -0.9; p < 0.001), ist jedoch weniger prädiktiv für Fussulzera als das Monofilament. Als pathologisch wird ein Wert ≤4/8 gewertet. Die Untersuchung sollte in ruhiger, entspannter Atmosphäre erfolgen. Zunächst wird dem Patienten am Handgelenk demonstriert, was er spüren sollte. Der Patient wird gebeten, die Augen zu schliessen und den Zeitpunkt zu nennen, ab dem er die Vibration nicht mehr spürt. Der Untersuchende beobachtet dabei die Dämpfer und beurteilt die Höhe des überlappenden Dreiecks anhand der seitlichen Zahlen. Es empfiehlt sich, den Test mehrmals zu wiederholen, um die Reproduzierbarkeit des Testergebnisses zu prüfen.
Eine Alternative ist die Vibrationsmessung mit dem VibraTip®. Verschiedene Studien haben die Präzision dieses Instruments aufgezeigt; weitere Studien stehen noch aus. Vom Patienten empfundene Vibration entspricht einem unauffälligen Testergebnis (> 4/8 auf der Stimmgabel nach Rydel-Seiffer).
Liniger C et al. The tuning fork revisited. Diabetic Med. 1990; 7:859–64; Kästenbauer et al., The value of the Rydel-Seiffer tuning fork as a predictor of diabetic polyneuropathy compared with a neu-rothesiometer. Diabetic Medicine 2004; 21:563-567; Papanas N, Ziegler D: New vistas in the diagnosis of diabetic polyneuropathy. Endocrine, 2014; 47(3): 690-6988; Nizar H et al. Diagnostic accuracy of the VibraTip in detection of diabetic peripheral neuropathy. Br J Diab Vasc Dis 2014; 14:26-29; Willits I, et al. VibraTip for Testing Vibration Perception to Detect Diabetic Peripheral Neuropathy: A NICE Medical Technology Guidance. Appl Health Econ Health Policy, 2015.
Zusatzinformationen
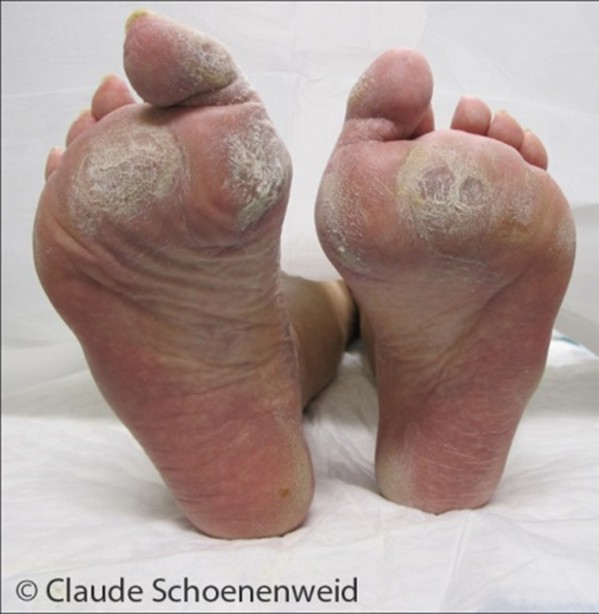
Hammer-/Krallenzehen
Patienten mit senso-motorischer Neuropathie haben oft Hammer- bzw. Krallenzehen, die zu Arealen erhöhten Drucks insbesondere unter den Metatarsale-Köpfchen und an den Zehen apikal, dorsal und interdigital führen.
Bus SA et al. Plantar fat-pad displacement in neuropathic diabetic patients with toe deformity. Diabetes Care 2004; 27:2376-2381 ; Bus SA et al. Elevated plantar pressures in neuropathic diabetic patients with claw/hammer toe deformity. Journal of Biomechanics 2005; 38:1918-1925.
Zusatzinformationen
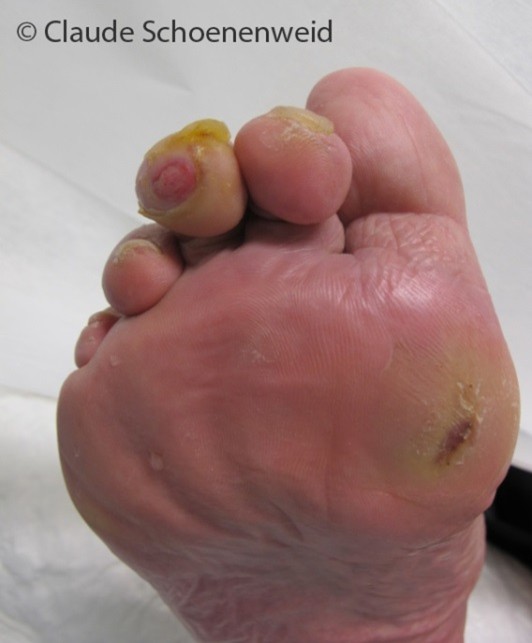
Hyperkeratose
Infolge wiederholter Traumata, die aufgrund einer sensorischen Neuropathie nicht als solche wahrgenommen werden, kann sich überschießende Hornhaut (Schwiele, Kallus) entwickeln. Diese verliert ihre physiologisch protektiven Eigenschaften und ist infolge einer Verhornungsstörung derb und hart. Unter der Hyperkeratose kommt es infolge persistent einwirkender Druck- und Scherkräfte oft zu Entwicklung sogenannter subkeratotischer Hämatome, aus denen sich schliesslich ein Ulkus entwickeln kann.
Murray et al. The Association Between Callus Formation, High Pressure and Neuropathy in Diabetic Foot Ulceration. DiabetMed 1996; 13:979-982.
Zusatzinformationen
Charcot Fuss
Der Charcot-Fuss oder Osteoneuroarthropathie ist ein progressiver Destruktionsprozess des Fuss-skelettes, der sich als Folge einer komplexen Pathogenese entwickelt. Klinisch sollte bei Vorliegen eines roten, geschwollenen und « heissen » Fusses ohne Ulkus in erster Linie die Diagnose eines Charcot-Fusses erwogen werden. Häufig wird diese Situation verwechselt mit einer tiefen Venentrombose, mit Gicht, Arthritis oder einer Infektionen. Verschiedene Aktivitätsstadien existieren: Entwicklungsstadium, Coalescence und die Consolidation. Als Auslöser gelten Verletzungen, Knochenfrakturen, chirurgische Eingriffe oder Ulzera bei vorhandener Neuropathie, aber in der Regel guter Durchblutung des Fusses. Die rechtzeitige Immobilisation und Entlastung, zum Beispiel mittels Unterschenkelgehgips ist essentiell für die Konsolidierung des Knochens und das Verhindern gröberer Deformationen. Je nach Verlauf kann die chirurgische Korrektion zur Wiederherstellung eines plantigraden Fusses indiziert sein, um das Ulkusrisiko zu reduzieren.
Rogers LC et al. The Charcot foot in diabetes. Diabetes Care. 2011; 34(9):2123-2129; Snyder et al. The management of diabetic foot ulcers through optimal off-loading. J Am Podiatr Med Assoc 2014; 104(6):555-567.
Zusatzinformationen
Terminale Niereninsuffizienz
In einer 2013 veröffentlichen Studie konnte gezeigt werden, dass Patienten mit Diabetes und terminaler Niereninsuffizienz bzw. Dialyse-Behandlung ein ebenso hohes Risiko für Fussulzera oder Amputationen haben wie Patienten mit vorangegangenem Ulkus oder Amputation. Die Inzidenzrate von Ulzerationen und Amputation war bei Patienten mit Diabetes unter Dialyse 3 bis 5 Mal höher als in der generellen Diabetiker-Population. Zudem konnte nur bei 48% der Dialyse-Patienten eine Heilung ihrer Erstläsionen beobachtet werden, im Gegensatz zu 67% bei Personen mit Ulkus-Rezidiv ohne Dialyse.
Lavery LA et al. Amputations and foot-related hospitalisations disproportionately affect dialysis patients. Int Wound J 2013; doi: 10.1111/iwj.12146.